Reacciones de oxidación reducción
trabajó en temas de anatomía descriptiva. También se dedicó a la anatomía comparada. En 1767 publicó un ensayo sobre los riñones de los pájaros, donde describe, entre otras cosas, las tres capas de la pared uretral y sus movimientos peristálticos y antiperistálticos tras la irritación. Publicó así mismo trabajos sobre la anatomía del oído de las aves, antes de que lo hiciera el anatómico Antonio Scarpa. Describió con cierta precisión la anatomía comparada del canal auditivo de varias especies de pájaros, mostrando con especial detalle los vasos sanguíneos, músculos y nervios del oído medio e interno.

John Dalton

Antonio Anastasio
Luigi Galvani (1737-1798)

En lo sucesivo, Luigi Galvani se dedicaría con esmero a estudiar a fondo el enigmático fenómeno y a reunir finalmente sus experiencias en una disertación escrita en latín: "Comentario sobre las fuerzas eléctricas que se manifiestan en el movimiento muscular" (De viribus electricitatis in motu musculari commentarius, 179l).



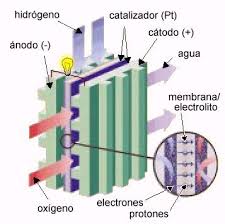
En la vida cotidiana, las reacciones químicas se pueden observar en las transformaciones de la materia. Como evidencia de ello existen: los cambios de color, los precipitados, la producción de gas o de calor.
Muchas ecuaciones químicas implican transferencia de electrones entre las substancias donde una de ellas se oxida y la otra se reduce. Aunque la mayoría de las ecuaciones se pueden balancear a simple vista o con varios intentos de “tanteo”, un sin número de ellas requiere el procedimiento adecuado de oxidación – reducción.
Por OXIDACIÓN se entiende la pérdida de electrones en un átomo o en un ión, es decir, su número de valencia aumenta.
La REDUCCIÓN se interpreta por la ganancia de electrones en un átomo o en un ión, es decir, su número de valencia disminuye.
Andrés Manuel del Río
1765-1849
trabajó en temas de anatomía descriptiva. También se dedicó a la anatomía comparada. En 1767 publicó un ensayo sobre los riñones de los pájaros, donde describe, entre otras cosas, las tres capas de la pared uretral y sus movimientos peristálticos y antiperistálticos tras la irritación. Publicó así mismo trabajos sobre la anatomía del oído de las aves, antes de que lo hiciera el anatómico Antonio Scarpa. Describió con cierta precisión la anatomía comparada del canal auditivo de varias especies de pájaros, mostrando con especial detalle los vasos sanguíneos, músculos y nervios del oído medio e interno.
El descubrimiento del vanadio
En 1801, al examinar muestras minerales procedentes de Zimapán en el actual Estado de Hidalgo en México, Andrés Manuel Del Río llegó a la conclusión de que había encontrado un nuevo elemento metálico. Preparó varios compuestos con él y al observar la diversidad de colores que presentaban, lo denominó "pancromio" (muchos colores, en griego). Poco después, al observar que los compuestos calentados cambiaban su color al rojo, denominó al nuevo elemento como eritronio (eritros, significa rojo en griego). Un año después entregó muestras que contenían el nuevo elemento a Alexander von Humboldt, quién los envió a Hippolyte Victor Collet-Descotils en París para su análisis. Collet-Descotils analizó las muestras e informó, equivocadamente, que contenía sólo cromo por lo que von Humboldt, a su vez, rechazó la pretensión de su amigo Don Andrés sobre un nuevo elemento.[1]
Antoine Laurent de
Lavoisier Paulze
Mineralogista madrileño, nacido en 1765, siguió estudios en los más importantes centros europeos de la época como Almadén, París, Freiberg y Chemnitz.
El químico francés Lavoisier, a pesar de no haber hecho ningún descubrimiento grandioso ni descubrir él mismo ningún elemento, es considerado generalmente como el fundador de la química moderna.
Aunque Lavoisier estudió leyes, nunca ejerció la abogacía, y a
los 21 años inició su sueño estudiando astronomía, geología, química y ciencias en general. Sus estudios geológicos y su proyecto sobre cómo iluminar las calles de una gran ciudad por la noche, le merecieron ser elegido miembro de la prestigiosa Academie des Sciences con tan sólo 25 años de edad. Su mayor mérito fue el de poner orden en las ideas de los alquimistas, establecer el concepto de “elemento”, introducir el empleo del
sistema métrico decimal y el de la balanza en los experimentos químicos, y sostener que la masa se conservaba en las reacciones, incluso cuando se formaban gases (La materia ni se crea ni se destruye - “Ley de conservación”). Ayudó a Priestley y a Sheele en la identificación del Oxígeno, fue capaz de descomponer y recomponer el agua, y explicó el fenómeno de la combustión y el de la respiración en términos de reacciones químicas que
implicaban al Oxígeno. En 1771 se casó con Marie-Anne Pierrete
Paulze – hija de uno de sus socios – que sólo contaba con 13 años. Con el tiempo, Mme. Lavoisier desarrolló un gran sentido científico
del conocimiento y a él se deben sobresalientes avances en materia de educación, moral, filosofía, teología, metafísica, economía política y ciencias naturales. Desde niño se caracterizó por su inteligencia y tesón. Estudió griego, latín, francés, alemán e italiano y por su cuenta aprendió caldeo, sirio, árabe y rudimentos de álgebra y geometría.
A pesar de su especial interés por la teología y su dedicación al ministerio eclesiástico, proyectó un rayo de luz sobre el oscuro y
confuso mundo de los gases, entonces compuesto por: aire nitroso (Ahora NO), aire flogistizado (N2O), aire ácido (HCl) y aire fijo reducido (CO). En 1774 proyectó un haz de luz solar con una lupa sobre una muestra de mercurio calcinado, obteniendo un gas
que hacía arder con fuerza a una vela, era prácticamente insoluble en agua y permitía que en él viviese un ratón. El mismo Priestley
manifestó: “He descubierto un aire cinco o seis veces superior que el aire corriente”. Este aire “superior” –al que llamó aire deflogistizado– fue presentado por él a Lavoisier, quien lo identificó como un elemento, al que llamó Oxígeno, por ser
generador de ácidos.John Dalton
En 1803, mientras trataba de explicar su ley de presiones parciales, comenzó a formular su mayor contribución a la ciencia: la teoría atómica. Se encontraba estudiando la reacción del óxido nítrico con oxígeno cuando descubrió que la reacción podía tener lugar con dos proporciones diferentes: a veces 1:1,7 y otras 1;3,4 (en peso). Ello llevó a Dalton a establecer la ley de las proporciones múltiples, que dice que los pesos de dos elementos siempre se combinan entre sí en proporciones de números enteros pequeños. En ese mismo año publicó su primera lista de pesos atómicos y símbolos.
Una buena parte de los descubrimientos de Dalton tuvieron su origen en la meteorología a la que se dedicó – junto con la química – haciéndola pasar de un entretenimiento folclórico a una disciplina científica (se ha dicho de él que fue el “padre de la meteorología”).
En 1803, mientras trataba de explicar su ley de presiones parciales, comenzó a formular su mayor contribución a la ciencia: la teoría atómica. Se encontraba estudiando la reacción del óxido nítrico con oxígeno cuando descubrió que la reacción podía tener lugar con dos proporciones diferentes: a veces 1:1,7 y otras 1;3,4 (en peso). Ello llevó a Dalton a establecer la ley de las proporciones múltiples, que dice que los pesos de dos elementos siempre se combinan entre sí en proporciones de números enteros pequeños. En ese mismo año publicó su primera lista de pesos atómicos y símbolos.
Antonio Anastasio
1745-1827
Inventor italiano que obtuvo por primera vez corriente continua, utilizando un procedimiento electroquímico. Fabricó la primera pila eléctrica, así llamada por estar constituida por una “pila” de laminas ternadas de metales diferentes separados por un electrolito-usó láminas de cobre y zinc y colocó entre ellas trozos de
cartón empapados en una solución salina-.
Este invento abrió un universo de infinitas aplicaciones que se extienden hasta nuestros días.
Luigi Galvani (1737-1798)
Luigi Galvani nació en Bolonia en 1737. Comenzó los estudios de teología que abandonó más tarde por los de medicina, persuadido por su familia, en 1755. Se graduó en 1759 en medicina y filosofía, como era habitual entonces. Tuvo como maestros a Jacopo Bartolomeo Beccari y Domenico Galeazzi.
En lo sucesivo, Luigi Galvani se dedicaría con esmero a estudiar a fondo el enigmático fenómeno y a reunir finalmente sus experiencias en una disertación escrita en latín: "Comentario sobre las fuerzas eléctricas que se manifiestan en el movimiento muscular" (De viribus electricitatis in motu musculari commentarius, 179l).




No hay comentarios:
Publicar un comentario